SMA如何可怕,药品审评中心都加速放行
【2019-05-10】
近日,用于治疗脊髓性肌萎缩症(SMA)的Spinraza注射液的上市申请(JXHS1800032)获得国家药品监督管理局正式批准。让人惊叹的是,Spinraza在美国是以加速批准方式获批,审评周期仅三个月,在国内的审批周期也不到6个月(173天)。其作为首批40个临床急需境外新药之一,可免国内临床试验直接申请上市,并享受CDE专门通道加快审评,这些无疑反映了国内临床对该药的迫切需求。那么SMA如何可怕,竟让药品审评中心(CDE)加速“放行”?
1 SMA的自述
“我是2岁以下婴幼儿群体中的头号遗传病杀手,是由于小朋友运动神经元里的SMN蛋白出了问题,使神经元大规模萎缩和死亡。患病的孩子随着生长,肌肉力量和运动能力衰减,严重者全身肌肉萎缩无力、运动功能逐渐丧失甚至影响吞咽和呼吸。重症者往往死于呼吸衰竭或严重的肺部感染。”“
2 准确打击
正因SMA的致病基因明确,科学家早已锁定SMA并致力开发药物。Spinraza(SMN2的靶向反义寡核苷酸)作为首个SMA治疗药物,于2016年12月获FDA加速批准上市。从此,SMA的治疗出现曙光。
对于SMA的了解与治疗进展,小微妹为您整理如下:
· 明确的致病基因:染色体 5q11.2-q13.3区域上的SMN1基因缺失/突变;(关于SMN基因的介绍,请阅读往期文章:你是准备好做父母了,但你问过基因的意见了吗?)· 高携带率:SMA为常染色体隐性遗传,在人群中的携带率约为1/50,在新生儿中的患病率为1/10000,中国大约有患儿3~5万人,每年新增1500-2500例;· 患者统计:按照患者能达到的身体功能指标,SMA被分为4个亚型。根据SMA之家统计,属于中重度的I型和II型患者占总人数近90%,男女比例及地域分布均未见显著差异;· 高昂治疗费用:目前唯一获批上市药物—Spinraza国内定价尚未曝露,其在美国的治疗费用相当昂贵,定价12.5万美元/针,首年需要6次注射,治疗费用为75万美元,第二年的费用减半为37.5万美元。另外,诺华制药子公司AveXis 的Zolgensma (暂名) 预计近日(2019年5月)于美国完成审评,计划定价为超过200万美元。· 多款药物研发中:除了Spinrana 和Zolgensma 外,罗氏和 Astellas 公司都有药物正在进行临床试验。
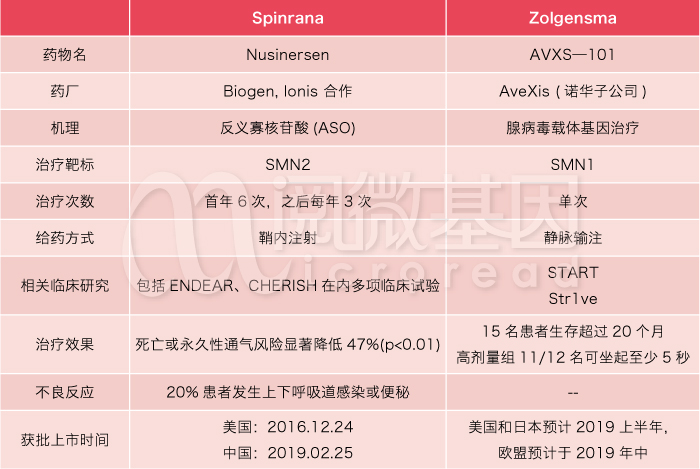
Spinrana vs Zolgensma
3 预防是关键
即使Spinraza在国内如此快速获批,但是其高昂的治疗费用是普通家庭难以承受的,所以对于千千万万个家庭来说,寻找有效方法来避免SMA患儿出生才是最直接的途径。而SMA的高携带率正是导致患儿出生的关键。

1/50*1/50*1/4 = 1/10000
出生缺陷主要分为三级预防,一级预防主要包括婚前检查、孕前或孕早期保健,以预防出生缺陷的发生;二级预防主要在孕期通过早发现、早诊断和早采取措施,以减少严重缺陷儿的出生;三级预防主要进行新生儿筛查,为了缺陷患儿出生后可以采取及时、有效的诊断治疗和康复。
为避免SMA患儿出生,最有效的预防是积极进行孕产前SMA基因携带者筛查。

4 国外筛查进展
· 2008年ACMG指南建议:对SMA进行泛族裔筛查,即不分区域、种族、对所有孕龄人群无差别实施SMN1携带者筛查;· 2017年美国ACOG指南建议:应对所有计划妊娠或已经妊娠者进行SMA筛查;· 2018年美国联邦咨询委员会建议所有新生儿进行SMA筛查。
5 SMA具体筛查流程

阅微基因始终秉持着让产品服务于每一个人的美好愿景,运用多种方法自主研发了多款SMA检测产品,可在一个反应内同时检测缺失和常见致病点突变,准确区分正常人、携带者及患者,可为临床医生和受检者提供SMA检测的整体解决方案,同时获得国内和国外相关专家认可。
参考文献:
1. Qu YJ, et al. (2016). Mutation Spectrum of the Survival of Motor Neuron 1 and Functional Analysis of Variants in Chinese Spinal Muscular Atrophy. J Mol Diagn. doi: 10.1016/j.jmoldx.2016.05.004.
2. 中华人民共和国卫生部(2012). 中国出生缺陷防治报告.
3. Prior TW; Professional Practice and Guidelines Committee. (2008). Carrier screening for spinal muscular atrophy. Genet Med. doi: 10.1097/GIM.0b013e318188d069.
4. Committee on Genetics. Committee Opinion No. 691: Carrier Screening for Genetic Conditions. Obstet Gynecol. 2017. doi: 10.1097/AOG.0000000000001952.
5. Glascock J, et al.(2018) Treatment Algorithm for Infants Diagnosed with Spinal Muscular Atrophy through Newborn Screening. J Neuromuscul Dis. doi: 10.3233/JND-180304.
6. http://media.biogen.com/news-releases/news-release-details/us-fda-approves-biogens-spinrazatm-nusinersen-first-treatment
7. Al-Zaidy S, et al. (2019). Health outcomes in spinal muscular atrophy type 1 following AVXS-101gene replacement therapy. Pediatr Pulmonol. doi:10.1002/ppul.24203.
8. http://www.pharmatimes.com/news/new_data_reinforce_effectiveness_of_novartis_zolgensma_for_sma_1284717







