检测结直肠腺瘤MSI状态作为早期筛查林奇综合征的有用策略
【2020-06-05】
结直肠癌(CRC)是世界上最常见的癌症之一,林奇综合征(LS)是最常见的遗传性结直肠癌综合征,占所有结直肠癌的2%~5%。腺瘤是LS相关性结直肠癌重要的癌前病变之一,散发性结直肠癌由腺瘤到癌变的过程一般需要 8~10 年,但LS相关腺瘤仅需 2~3 年。尽早发现LS是非常可取的,因为随着癌症监测比例的增加,可以显著降低患CRC的风险。
Lynch综合征结直肠癌发生的分子途径
MSI发生在超过90%的LS中,是LS筛查的分子标志。通常认为MSI是结肠肿瘤发展的早期事件,是腺瘤的晚期事件,然而研究显示[1]大部分LS相关结直肠癌是由早期MMR缺陷的前体病变发展而来,主要由MMR缺陷型隐窝(MMR‐DCF),通过腺瘤阶段发展而来。即LS中的MSI主要在腺瘤形成的早期阶段发生。因此筛查结直肠腺瘤性息肉的MSI状态将成为早期鉴定LS的有用策略。
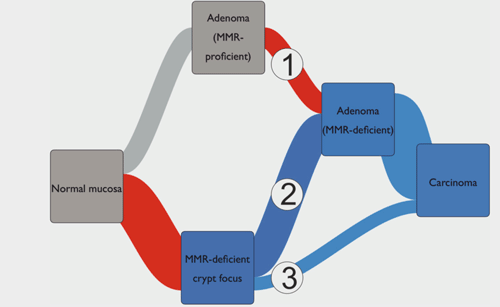
Lynch综合征结直肠癌发生的三种分子途径
可行性分析研究
朱方超等人[2]对大肠息肉LS筛查策略的研究中,对508例常规腺瘤进行分析,6例腺瘤为dMMR,占所有腺瘤的1.18%。6例腺瘤的发病位置无明显差异,平均年龄50岁,腺瘤平均大小1.7 cm,其中2例腺瘤高度不典型增生,一例伴有恶性成分,其余两例没有进展但有癌症家族史。5例患者进行了MMR基因检测,结果两例为致病性突变,一例疑似致病性突变。文章得出结论:可以通过选择患者或息肉来提高筛查策略。比如可以关注存在高危特征的患者,如体积大、绒毛状、高度不典型增生和伴有恶性成分等。

6例dMMR患者详细数据
多项研究表明腺瘤的dMMR/MSI检测对LS有一定的诊断价值,综合以往报道dMMR/MSI在MMR突变携带者腺瘤占50%~86%[3] ,散发性腺瘤性息肉dMMR/MSI的发生率不到3%[4],而在散发性结肠直肠癌中,MSI的发生率为10 %~15%。事实上,相当比例的散发性结直肠癌显示MSI,这使得MSI在恶性肿瘤中成为LS的一个相对非特异性的标记物。因此筛查腺瘤具有灵敏度降低、特异性高的特点。
荟萃分析
Parag D. Dabir 等人[5]在European Journal of Human Genetics 上发表的一的一项荟萃分析,最终共纳入41项研究,分别包含519例LS患者和1698例未选择患者两个队列,分别分析883和2119个常规腺瘤,评估在LS和未被选择的患者腺瘤中dMMR/MSI的发生率和危险因素,以探讨dMMR/MSI在腺瘤中作为LS的生物标志物的潜力。
结果在LS队列中69.5%的常规腺瘤中存在dMMR / MSI,而未选择的患者中为2.8%。dMMR / MSI在MLH1、MSH2、MSH6基因突变中的平均比例分别为79.9%和73.4%和52.8%,没有显著差异。
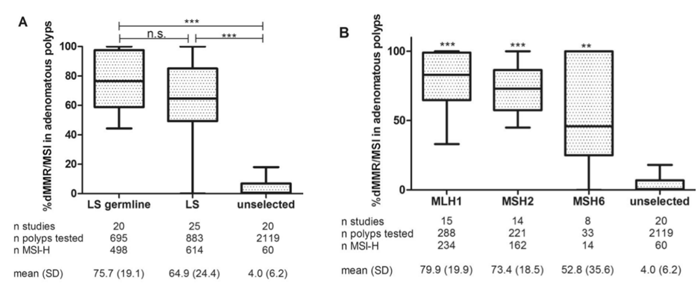
A:dMMR/MSI在基因确诊的LS、所有LS和未选择患者中的占比
B:特定种系变异对dMMR/MSI存在的影响
在LS队列的亚组分析中,dMMR/MSI在60岁以上的患者(82%)、绒毛状腺瘤(84%)、1 cm以上的腺瘤(81%)和高度不典型增生的腺瘤(88%)中更为常见。dMMR / MSI在腺瘤位置方面未观察到显着差异。
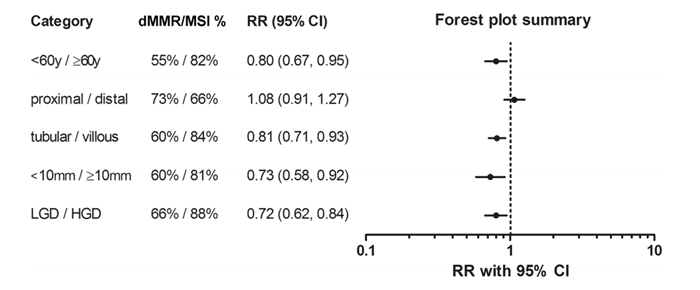
LS患者dMMR/MSI的相对风险分析
研究得出的结论:以腺瘤的dMMR/MSI状态作为LS的诊断标志,其敏感性为69.5% (95% CI 66.4~72.6),特异性为97.2% (95% CI 96.4~97.8)。通过关注进展腺瘤,敏感度可以提高到81%~88%。CRC人群筛查结果显示,在进行结肠镜检查的患者中,有3.9%~41%[6]的患者发现晚期腺瘤。
(值得注意的是,可能存在LS相关癌的一个少见亚群,它们起源于MMR缺陷的隐窝,绕过了腺瘤样前体病变,而这些病变不包括在分析中。)
LS的筛查管理办法
过去LS的初步诊断是基于癌症家族史,主要根据阿姆斯特丹II或贝塞斯达修订标准,由于具有较高的漏诊率,目前的指南建议所有新诊断的CRC患者进行MSI/MMR检测。2020 V1版结直肠癌NCCN指南,首次将MSI/MMR检测提前到了息肉阶段,原文建议有蒂或无蒂息肉(腺瘤)伴浸润性癌可行MSI/MMR检测[7]。
目前LS的具体筛查流程一般先筛查先证者腺瘤或肿瘤组织MMR/MSI,MMR基因突变分析作为LS的确诊手段[8]。
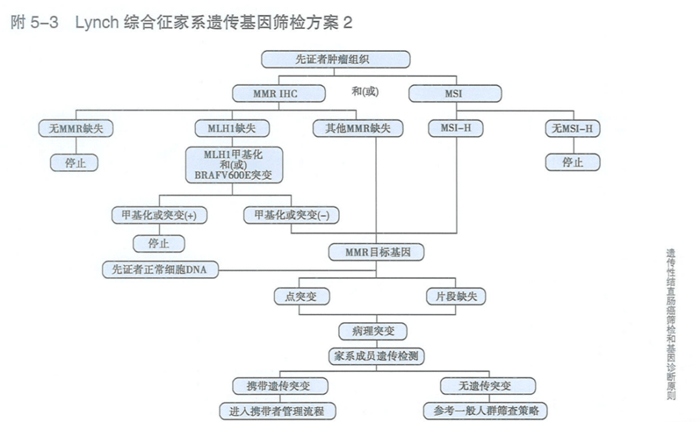
Lynch综合征基因筛检方案
LS家系成员进行遗传分析,如果确定为MMR基因致病性突变携带者,则进入携带者随访监控程序。

Lynch家系携带者随访监控策略
综上,结直肠癌谱系在向腺瘤和早期癌症转移。息肉阶段确诊LS并进行有效的随访监控,对个人及家属的癌症的预防具有重要意义,研究表明,LS家庭结肠镜检查的15年随访有效降低了65%~70%的死亡率[9]。腺瘤中的dMMR/MSI是一种强有力的LS标记物,目前可以通过关注进展的晚期腺瘤,提高检测的敏感性。

扫码回复 NCCN结直肠癌
获取 最新2020 V2版结直肠癌NCCN指南
参考文献
1.Aysel Ahadova,et al. (2018). Three molecular pathways model colorectal carcinogenesis in L ynch syndrome.Int J Cancer.
DOI:10.1002/ijc.31300
2.Zhu F,et al. (2019). Single-center study of Lynch syndrome screening in colorectal polyps. Hered Cancer Clin Pract.
DOI: 10.1186/s13053-019-0108-6
3.Bacher JW,et al.(2015).Improved Detection of Microsatellite Instability in Early Colorectal Lesions. PLoS One.
DOI: 10.1371/journal.pone.0132727
4.Loukola A, et al.(1999). Microsatellite instability in adenomas as a marker for hereditary nonpolyposis colorectal cancer.Am J Pathol.
DOI: 10.1016/S0002-9440(10)65503-4
5.Parag D. Dabir,et al. (2019). Microsatellite instability screening in colorectal adenomas to detect Lynch syndrome patients A systematic review and meta-analysis. European Journal of Human Genetics.
DOI: 10.1038/s41431-019-0538-7
6.Navarro M, et al.(2017). Colorectal cancer population screening programs worldwide in 2016: an update. World J Gastroenterol.
DOI: 10.3748/wjg.v23.i20.3632
7.结直肠癌NCCN指南2020V1版
8.2019结直肠癌CSCO指南
9.Jarvinen HJ, et al.(2009). Ten years after mutation testing for Lynch syndrome: cancer incidence and outcome in mutation-positive and mutation-negative family members. J Clin Oncol.
DOI: 10.1200/JCO.2009.23.7784







