从中国人群大数据分析林奇综合征检测的有效策略
【2020-07-09】
林奇综合征(LS)是遗传性结直肠癌(CRC)的常见形式,是由DNA错配修复(MMR)基因的种系突变引起。早期识别LS患者非常重要,研究表明,对LS患者和MMR突变携带者的定期结肠镜检有效降低了65%的死亡率。
目前对于LS的诊断依赖于MMR基因的种系分析,但是如何为个体选择有效的MMR基因种系检测以提高筛查效率至关重要。目前国际上LS临床筛查策略主要依据NCCN、ESMO或CSCO推荐的分子检测标准,但这在中国人群中的可行性和有效性一直缺乏大规模数据评估。
中国人群LS筛查数据
中国医学科学院肿瘤医院病理科应建明教授、邹霜梅教授、董林博士团队[1]的研究,总共纳入4195名符合条件的CRC患者,是迄今中国最大的LS回顾性研究。研究显示中国CRC中dMMR占比8.7%,LS占比2.7%。
研究方法
在病理诊断阶段,对CRC患者常规进行MMR蛋白和BRAF V600E的免疫组化(IHC)分析。MLH1缺乏的BRAF野生型患者进行MLH1启动子甲基化分析,接下来进行有针对性的二代测序和MLPA检测,具体如下图。
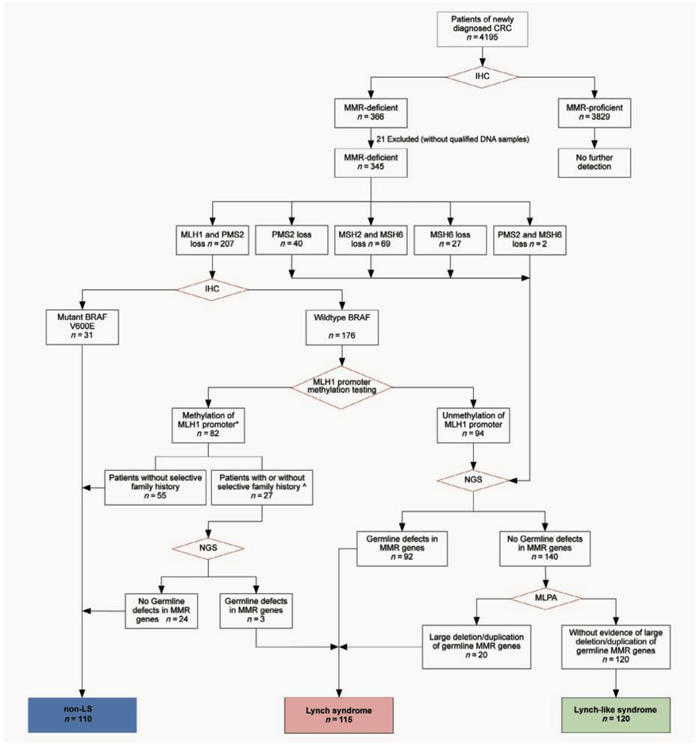
应建明教授、邹霜梅教授、董林博士团队研究流程图
在分析这个筛查策略之前,先来了解下CRC的分子特征。
CRC的分子特征
CRC是由于细胞内多种遗传和表观遗传畸变逐步累积导致的,从腺瘤到癌的发展由三个主要途径引起[2]:
■ 染色体不稳定(CIN)途径: 具有致癌基因(如KRAS)激活和抑癌基因(如APC,SMAD4和TP53)失活的常规腺瘤-癌途径,发生在约85%的CRC中。
■ 微卫星不稳定(MSI)途径: 发生在约15%的散发性CRC和90%以上的LS中,其中散发性CRC MSI表型几乎完全与 MLH1启动子甲基化有关。
■ CpG岛甲基化(CIMP)途径: 具有CpG岛甲基化表型的锯齿状途径,引起约35%的CRC。如果在MLH1启动子中发生甲基化,则导致MSI-H癌症,如果在肿瘤抑制基因中发生甲基化,则导致MSS癌症。
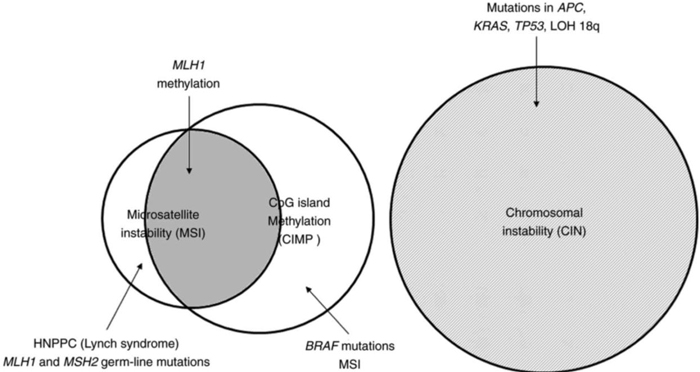
驱动CRC发生和发展的遗传和表观遗传分子途径[3]
LS的分子诊断
1. MMR与MSI
MMR蛋白IHC检测、MSI检测或两者同时检测均可以作为LS的初筛,IHC和MSI检测各有优缺点。
IHC主要优点是能够特异性地鉴定可能存在缺陷的MMR蛋白以及易得性,然而,IHC的判读具有较大主观性。并且对于某些已治疗的CRC和约10%MMR蛋白功能缺陷的CRC患者,IHC结果可能造成误判。基于PCR的MSI检测则需要足够的肿瘤组织,但是检测结果客观准确。
Leticia Moreira等人[4]的研究表明,1395例pMMR CRC患者中有12例(0.9%)存在LS相关的致病性种系突变。提示不采用补充的MSI试验,将会漏检一小部分LS患者,所以有条件的单位,应推荐两种检测方法同时进行,互为验证,提高检测的敏感性。并且对所有新诊断的CRC病例进行无偏见的MMR和MSI检测可能会成为识别所有LS病例的最有效方法。
2. MLH1甲基化与BRAF突变
MSI-H的CRC可能是散发性或遗传性的,大多数MSI-H CRC由MLH1启动子甲基化导致散发性CRC,IHC显示MLH1和PMS2丢失。散发性MSI-H的CRC经常伴有BRAF V600E突变,这在LS相关CRC中极为罕见。
所以,对于MSI-H或IHC检测MLH1和PMS2缺失时,BRAF突变和MLH1启动子甲基化检测可作为排除LS的标准。在应建明教授团队的研究中显示,中国MLH1缺乏的CRC患者中BRAF V600E突变占比15%,这一数据明显低于以往的报道,文章解释可能与入组人群性别相关。结合MLH1启动子甲基化检测,可将MMR基因种系分析的转诊率降低31.9%。
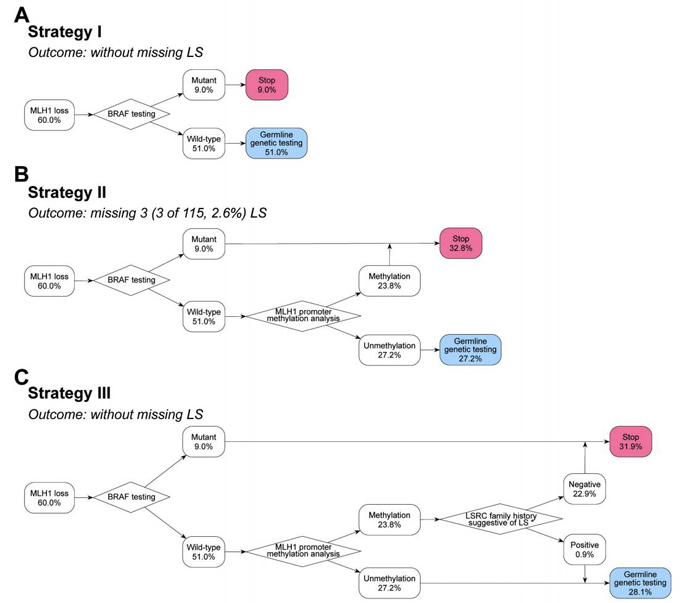
MLH1缺失组(n=207)的三种不同筛查方法示意图
(策略Ⅲ被认为更适合中国CRC患者LS的筛查)
值得注意的是:研究显示[5]约1%的LS同时伴有BRAF突变。同样有体细胞MLH1启动子甲基化的LS患者的相关报道,在应建明教授团队的研究中也显示了3.7%的MLH1启动子甲基化的LS个体。强调了对于有LS家族史的个体,BRAF V600E突变和MLH1启动子甲基化均不能排除LS的可能性。
另外,Tomer Adar等人[6]的研究中显示:MLH1蛋白缺失时,BRAFV600E和MLH1甲基化总体一致性为81%,BRAF突变预测MLH1启动子甲基化的阳性预测值和阴性预测值分别为98.9%和41%。
3. NGS与MLPA
MMR基因种系突变是诊断LS的标准,应建明教授团队[1]的研究显示LS患者中82.6%存在点突变或小的基因组改变,可用NGS技术检测,17.4%存在大片段重排(Large genomic rearrangements ,LGRs),需要借助MLPA技术检测。
另外,对于具有MSI-H或IHC显示MMR蛋白缺失(排除MLH1甲基化),但是胚系检测未见MMR基因致病突变的病例诊断为“Lynch样综合征”,约占临床怀疑Lynch综合征的60~70%。文献中对于lynch样综合征有许多不同解释[7],可能由于目前技术尚未能检测出MMR基因的某些胚系突变,例如在内含子序列或启动子序列的突变;其次还有的认为除了MMR胚系突变外还存在其他机制,同样导致MMR基因失活。这部分病例多存在体细胞MMR双等位基因突变。
综上,LS的诊断应考虑将MMR和MSI检测以及BRAF突变和MLH1启动子甲基化的混合检测作为新诊断CRC常规检测的一部分,以提高筛查效率。并且,包括NGS和LGRs检测在内的全面分子检测策略,对于在临床实验室环境下诊断LS是必要的。
扫码回复 0709 获取文献原文

阅微基因在CE平台上有着丰富的研发经验,一直处于国内前沿,可以非常精准地对单核苷酸的微卫星状态进行判读。Micoread MSI Panel(MR-panel3,6核心位点)在检测技术和临床应用上都有独特的优势,阅微基因微卫星不稳定性检测试剂盒已经递交了国家第三类体外诊断试剂的注册申请。相信在不久的将来该试剂能够应用到临床,切实地为患者服务。
与此同时,阅微基因的分子诊断产品研发跨足肿瘤个体化诊疗、生殖遗传及精准用药指导三个主要方面,以系列产品打造相关领域的整体解决方案。
产品特色
1. 位点准确完善:包含NCI建议的所有单核苷酸位点,并增加可用以识别潜在样品混杂或污染的检测标的,降低错误风险 (专利号 : ZL 2011 1 0152226. X)
2. 操作简单快捷: 一管式扩增,全程只需3.5小时,适于自动化、批量化检测
3. 结果直观易读:专业软件辅助结果分析判读,快速简便
参考文献
1. Dong L, et al. ( 2020). Distinct clinical phenotype and genetic testing strategy for Lynch syndrome in China based on a large colorectal cancer cohort.Int J Cancer.
DOI:10.1002/ijc.32914
2. Gonzalez, R.S.,et al. (2017). Current applications of molecular pathology in colorectal carcinoma. Appl Cancer Res.
DOI:10.1186/s41241-017-0020-1
3. Ha N,et al. (2018). The molecular characteristics of colorectal cancer: Implications for diagnosis and therapy (Review)[J]. Oncology Letters.
DOI: 10.3892/ol.2018.8679
4. Moreira L, et al. (2012). Identification of Lynch syndrome among patients with colorectal cancer. JAMA.
DOI:10.1001/jama.2012.13088
5. Parsons MT, et al. (2012). Correlation of tumour BRAF mutations and MLH1 methylation with germline mismatch repair (MMR) gene mutation status: a literature review assessing utility of tumour features for MMR variant classification. J Med Genet.
DOI:10.1136/jmedgenet-2011-100714
6. Adar, T.et al. (2017). A tailored approach to BRAF and MLH1 methylation testing in a universal screening program for Lynch syndrome. Mod Pathol.
DOI:10.1038/modpathol.2016.211
7. Carethers JM. (2014). Differentiating Lynch-like from Lynch syndrome.Gastroenterology.
DOI:10.1053/j.gastro.2014.01.041







